一、办理条件
(1)具有申请医疗器械注册证首次核发受理通知书
(2)有与生产的医疗器械相适应的生产场地、环境条件、生产设备以及专业技术人员;企业应当具有与所生产产品及生产规模相适应的生产设备,生产、仓储场地和环境。企业生产对环境和设备等有特殊要求的医疗器械的,应当符合国家标准、行业标准和国家有关规定;
(3)有对生产的医疗器械进行质量检验的机构或者专职检验人员以及检验设备;企业的生产、质量和技术负责人应当具有与所生产医疗器械相适应的专业能力,并掌握国家有关医疗器械监督管理的法律、法规和规章以及相关产品质量、技术的规定,质量负责人不得同时兼任生产负责人;
(4)有保证医疗器械质量的管理制度;
(5)有与生产的医疗器械相适应的售后服务能力;
(6)符合产品研制、生产工艺文件规定的要求;
(7)企业应当保存与医疗器械生产和经营有关的法律、法规、规章和有关技术标准。
二、申请材料清单
1.注册申请人基本情况表
2.注册申请人组织机构图
3.企业总平面布置图、生产区域分布图
4.如生产过程有净化要求的应提供有资质的检测机构出具的环境检测报告(附平面布局图)复印件
5.产品生产工艺流程图,应标明主要控制点与项目及主要原材料、采购件的来源及质量控制方法
6.主要生产设备和检验设备(包括进货检验、过程检验、出厂的最终检验设备;如需净化生产的,还应提供环境监测设备)目录
7.企业质量管理体系自查报告
8.拟核查产品与既往已通过核查产品在生产条件、生产工艺等方面的对比说明(如适用)
9.部分注册申报资料的复印件: (一)医疗器械(不包括体外诊断试剂):研究资料、产品技术要求、注册检验报告、临床试验报告(如有)、医疗器械安全有效基本要求清单。(二)体外诊断试剂:主要生产工艺及反应体系的研究资料(第三类体外诊断试剂)、产品技术要求、注册检验报告、临床试验报告(如有)
10.注册受理凭证
11.申请材料真实性的自我保证声明,包括申请材料目录和企业对材料作出如有虚假承担法律责任的承诺,申请检查确认书
三、办理依据
1. 法律法规名称:《体外诊断试剂注册管理办法》
依据文号:2014年国家食品药品监督管理总局令第5号 第四十四条
2.法律法规名称:《医疗器械注册管理办法》
依据文号:2014年国家食品药品监督管理总局令第4号 第三十四条
3.法律法规名称:《食品药品监管总局关于印发境内第三类医疗器械注册质量管理体系核查工作程序(暂行)的通知》
依据文号:食药监械管〔2015〕63号 条款号正文及附件第三条
4. 法律法规名称:《关于印发广东省第二类医疗器械注册质量管理体系核查工作程序(暂行)的通知》
依据文号:食药监办械安〔2015〕552号 条款号正文及附件第三条
5. 法律法规名称:国家食品药品监督管理总局关于发布医疗器械生产质量管理规范的公告
依据文号:2014年第64号 条款号全文
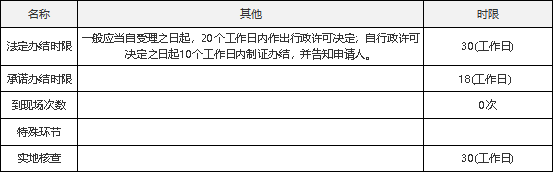
四、办理时间