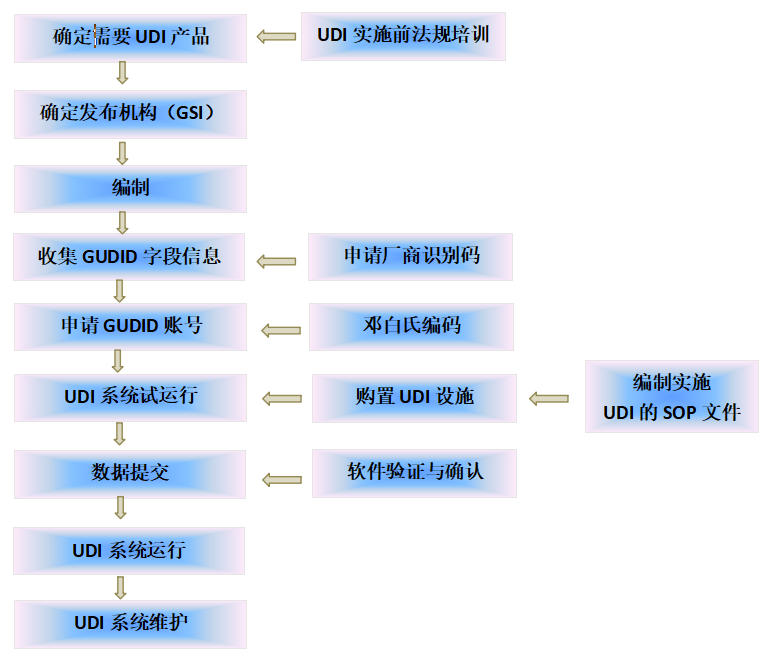
一、办理介绍
2016年9月24日开始,FDA要求进入美国市场的二类器械包装和标签必须具有UDI码。这一类产品约占美国医疗器械总量的60-70%,中国出口美国的医疗器械也大多属于这一类。
FDA要求UDI必须满足纯文本形式和自动识别技术(Automatic Identification and Data Capture, AIDC),通俗点说,就是人和机器都能够识别相应编码。
UDI的标识要求大体上根据器械的不同使用方式分成这四类: 1)使用超过一次的器械, 应在最小销售单元及上级包装上标识人机均可读的UDI。最终要求是必须把相应UDI直接标识在器械上,可以以纯文本或自动识别技术标识。2)一次性使用器械,不必在每套一次性使用器械上都标识UDI,应在最小销售单元包装及上级包装上标识。3)植入器械,UDI应标识在每个器械的包装及上级包装上。4)独立软件,软件的版本应包含在PI中。如果软件通过网络下载,启动软件时或使用菜单命令可显示纯文本的UDI即可;如果软件通过包装进行销售,除满足上述要求外,包装标签上必须具有人机均可读的UDI.。
二、服务流程