一、办理介绍
CE为法文CONFORMITE EUROPEENNE的首字母缩写,表示“欧洲统一”,也代表产产品安全。
CE适用的区域包括:欧盟EU+欧洲经济区EEA+东欧,共31个国家。很多除欧盟外的国家,除美国FDA、日本PAL、澳大利亚TGA等,绝大数通行欧洲颁发的自由销售证书CFS。
CE标志是一种安全认证标志,凡贴有CE标志的产品均可在欧盟各成员国内销售,无须符合各个成员国的要求。使用CE标志,实现了商品在欧盟成员国范围内的自由流通,因此CE标志被视为制造商打开并进入欧洲市场的通行证。
在欧盟市场“CE”标志属强制性认证标志,不论是欧盟内部企业生产的产品,还是其他国家生产的产品,要想在欧盟市场上自由流通,就必须加贴“CE”标志,以表明产品符合欧盟《技术协调与标准化新方法》指令的基本要求, 加贴“CE”标志必须识别很多协调标准,这是欧盟法律对产品提出的一种强制性要求。
欧盟对医疗器械的监管,主要是依据三大指令来实现的,大部份医疗器械产品均需要通知欧盟监管机构认可的公告机构来完成,只有少部份MDD中的普通一类,IVD设备中的其它类及自测设备,才可以由制造商通过自我声明的方式在欧盟境内销售。
医疗器械指令
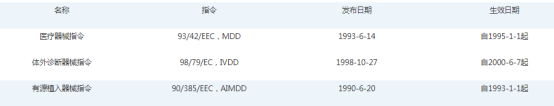
2007年9月5日针对93/42/EEC指令和90/389/EEC指令的修改,指令正式颁布在欧盟的官方公告上,2010年3月21日上市或投入使用的医疗器械产品必须符合修订后指令的要求。
2017年5月5日,2017/745、2017/746法规颁布,取代了原来的三大指令,新法规有三年过渡期,将在法规颁后的三年后强制实施。
我们IMD医美达医疗器械咨询CE认证咨询服务包括:
1.公司质量手册和程序文件的建立;
2.协助公司完成第三层文件,包括CE技术文件;
3.提供CE认证相关的法律和法规文件;
4.协助公司完成产品的性能测试;
5.公司质量体系的运行和完善;
6.指导公司进行内部审核和管理评审;
7.帮助公司顺利完成产品的CE认证现场审核;
8.协助公司完整CE的监督审核
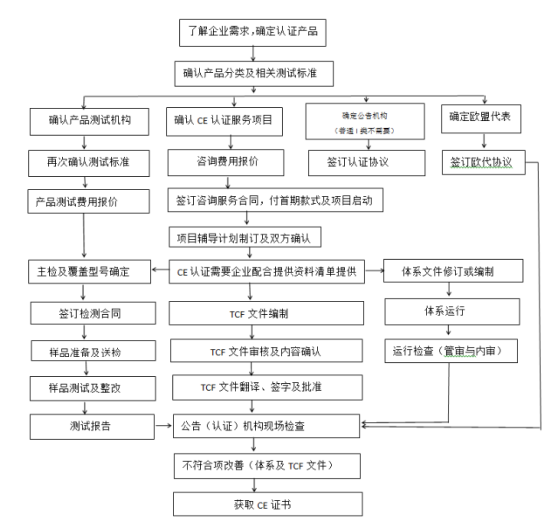
二、办理流程